Em um sistema termodinâmico, é fundamental a avaliação da variação da energia interna de um sistema para a determinação de propriedades tais como pressão e temperatura. A energia interna de um sistema é dada pela soma da energia cinética e potencial das partículas que o constituem. A expressão para calcular a energia interna de um gás é dada por:
n = número de mols
R = constante universal dos gases
T = Temperatura do gás em Kelvin
A primeira lei da termodinâmica consiste na aplicação do balanço energético em um sistema, ou seja, se uma quantidade de calor for acrescentada a um sistema, parte do calor adicionado será acumulado, aumentando a energia interna do sistema, e parte será utilizado para a geração de trabalho, matematicamente temos:
Q = calor adicionado ao sistema;
∆U = variação da energia interna;
W = trabalho realizado;
Dentre as transformações gasosas temos:
Transformação isotérmica
Nesta transformação, não há variação de temperatura do sistema e, portanto, a variação da energia interna é nula.

Pelo diagrama P-V acima:
Em uma transformação isobárica a pressão do sistema se mantém constante:

Pela figura acima:
Neste tipo de transformação o volume permanece constante, e, portanto, o trabalho realizado é nulo.

Transformação adiabática
Na transformação adiabática não há troca de calor no sistema, ou seja, Q = 0:
O ciclo de Carnot é o ciclo ideal da termodinâmica. Neste ciclo, é obtida a maior eficiência possível de um sistema. São realizadas 4 transformações termodinâmicas neste ciclo, sendo 2 isotérmicas intercaladas por 2 adiabáticas, como mostra o diagrama abaixo.

A eficiência (rendimento) do ciclo de Carnot é dada por:
Onde:
T\(_F\) = temperatura da fonte fria;
T\(_Q\) = temperatura d fonte quente;
(FUVEST) No diagrama P x V da figura, A, B e C representam transformações possíveis de um gás entre os estados I e II.

Com relação à variação ΔU da energia interna do gás e ao trabalho W por ele realizado, entre esses estados, é correto afirmar que
(UNIOESTE) Em um sistema fechado, um gás ideal passa lentamente de um estado inicial 1 para um estado final 2 devido a uma expansão isotérmica. Assim, ao final deste processo termodinâmico,
(FAC. ALBERT EINSTEIN - MEDICINA) Para provocar a transformação gasosa ABC representada no diagrama P X V em determinada massa constante de gás ideal, foi necessário fornecer-lhe 1.400 J de energia em forma de calor, dos quais 300 J transformaram-se em energia interna do gás, devido ao seu aquecimento nesse processo.

Considerando não ter havido perda de energia, o trabalho realizado pelas forças exercidas pelo gás no trecho AB dessa transformação foi de
TEXTO PARA A PRÓXIMA QUESTÃO:
Um gás ideal contido em um cilindro com pistão pode ser levado de um estado inicial até um estado final seguindo dois processos distintos, I e II, conforme ilustrado na figura abaixo.

(UFRGS) Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
No processo I, o gás sofre duas transformações sucessivas, sendo a primeira __________ e a segunda __________. A variação de energia interna no processo I, ΔU\(_{\text{I}}\) é __________ variação de energia interna no processo II, ΔU\(_{\text{II}}\).
(UFPR) Em Termodinâmica, estudamos processos importantes que fazem parte de ciclos utilizados em máquinas térmicas, alguns dos quais de grande relevância tecnológica, além de científica. Com relação ao que ocorre com um gás ideal, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) Em todo processo isovolumétrico, também chamado de isocórico, o trabalho realizado pelo gás é nulo.
( ) Em todo processo adiabático, a energia interna do gás é constante.
( ) Em todo processo isobárico, não há trocas de calor entre o gás e o meio externo.
( ) Em todo processo isotérmico, a temperatura do gás aumenta quando há realização de trabalho sobre ele.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
(UDESC) Considere as afirmações com relação à Termodinâmica.
I - A energia interna de uma dada quantidade de gás ideal depende apenas da temperatura.
II - Quando um sistema pode ir do estado (1) para o estado (2) por vários processos diferentes, a quantidade de calor absorvida pelo sistema será a mesma para todos os processos.
III - Quando um sistema pode ir do estado (1) para o estado (2) por vários processos diferentes, a variação da entropia do sistema será a mesma para todos os processos.
IV - Quando um sistema pode ir do estado (1) para o estado (2) por vários processos diferentes, a variação da energia interna do sistema será a mesma para todos os processos.
V - Quando um sistema pode ir do estado (1) para o estado (2) por vários processos diferentes, a quantidade de trabalho realizado sobre o sistema será a mesma para todos os processos.
Assinale a alternativa correta.
(ESPCEX (Aman)) Durante um experimento, um gás perfeito é comprimido, adiabaticamente, sendo realizado sobre ele um trabalho de 800J Em relação ao gás, ao final do processo, podemos afirmar que:
(UEFS) A primeira lei da termodinâmica para sistemas fechados foi originalmente comprovada pela observação empírica, no entanto é hoje considerada como a definição de calor através da lei da conservação da energia e da definição de trabalho em termos de mudanças nos parâmetros externos de um sistema.
Com base nos conhecimentos sobre a Termodinâmica, é correto afirmar:
(EPCAR(Afa)) Um sistema termodinâmico constituído de n mols de um gás perfeito monoatômico desenvolve uma transformação cíclica ABCDA representada no diagrama a seguir.

De acordo com o apresentado pode-se afirmar que
(G1 - IFSUL) Abaixo temos o diagrama p x V onde estão representadas três transformações que levam um gás ideal do estado inicial (i) para o estado final (f).

Considerando o estudo das transformações gasosas, os três processos aos quais o gás é submetido são, respectivamente
(UDESC) Analise as proposições com relação às leis da termodinâmica.
I - A variação da energia interna de um sistema termodinâmico é igual à soma da energia na forma de calor fornecida ao sistema e do trabalho realizado sobre o sistema.
II - Um sistema termodinâmico isolado e fechado aumenta continuamente sua energia interna.
III - É impossível realizar um processo termodinâmico cujo único efeito seja a transferência de energia térmica de um sistema de menor temperatura para um sistema de maior temperatura.
Assinale a alternativa correta.
(UDESC) Em um laboratório de física são realizados experimentos com um gás que, para fins de análises termodinâmicas, pode ser considerado um gás ideal. Da análise de um dos experimentos, em que o gás foi submetido a um processo termodinâmico, concluiu-se que todo calor fornecido ao gás foi convertido em trabalho.
Assinale a alternativa que representa corretamente o processo termodinâmico realizado no experimento.
(UFPR) O estudo da calorimetria e das leis da termodinâmica nos dá explicações para vários fenômenos encontrados na natureza. Considere o seguinte texto que apresenta a explicação, do ponto de vista dessas áreas da Física, para a formação das nuvens:
Quando uma porção de ar aquecido sobe, contendo água que acabou de __________ da superfície, passa a estar submetida a uma pressão cada vez __________. A rápida variação na pressão provoca uma rápida expansão do ar junto com uma redução de seu/sua __________. Essa rápida expansão é considerada __________, isto é, sem troca de calor com sua vizinhança, porque ocorre muito rapidamente. O gás em expansão __________ energia interna ao se expandir, e isso acarreta seu resfriamento até atingir uma temperatura na qual a quantidade de vapor de água é suficiente para saturar o ar naquele ponto e assim formar as nuvens.
Assinale a alternativa que preenche as lacunas corretamente.
(UFSM) A respeito dos gases que se encontram em condições nas quais seu comportamento pode ser considerado ideal, afirma-se que
I - a grandeza que é chamada de temperatura é proporcional à energia cinética média das moléculas.
II - a grandeza que é chamada de pressão é a energia que as moléculas do gás transferem às paredes do recipiente que contém esse gás.
III - a energia interna do gás é igual à soma das energias cinéticas das moléculas desse gás.
Está(ão) correta(s)
(UPE) O diagrama PV para uma determinada amostra de gás está representado na figura a seguir. Se o sistema é levado do estado a para o estado b, ao longo do percurso acb, fornece-se a ele uma quantidade de calor igual a 100 cal, e ele realiza um trabalho de 40 cal.
Se, por meio do percurso adb, o calor fornecido é de 72 cal, então o trabalho realizado vale em cal:

(EFOMM) Um mol de um gás ideal monoatômico vai do estado a ao estado c, passando pelo estado b com pressão, como mostrado na figura abaixo. A quantidade de calor Q que entra no sistema durante esse processo é de aproximadamente:

(IME) Considere as afirmações abaixo, relativas a uma máquina térmica que executa um ciclo termodinâmico durante o qual há realização de trabalho.
I - Se as temperaturas das fontes forem 27ºC e 427ºC, a máquina térmica poderá apresentar um rendimento de 40%.
II - Se o rendimento da máquina for 40% do rendimento ideal para temperaturas das fontes iguais a 27ºC e 327ºC e se o calor rejeitado pela máquina for 0,8 kJ o trabalho realizado será 1,8 kJ.
III - Se a temperatura de uma das fontes for 727ºC e se a razão entre o calor rejeitado pela máquina e o calor recebido for 0,4, a outra fonte apresentará uma temperatura de -23ºC no caso de o rendimento da máquina ser 80% do rendimento ideal.
Está(ão) correta(s) a(s) seguinte(s) afirmação(ões):
(ENEM PPL) Rudolph Diesel patenteou um motor a combustão interna de elevada eficiência, cujo ciclo está esquematizado no diagrama pressão x volume. O ciclo Diesel é composto por quatro etapas, duas das quais são transformações adiabáticas. O motor de Diesel é caracterizado pela compressão de ar apenas, com a injeção de combustível no final.

No ciclo Diesel, o calor é absorvido em:
(ACAFE) Considere o caso abaixo e responda: Qual é a transformação sofrida pelo gás ao sair do spray?

As pessoas com asma, geralmente, utilizam broncodilatadores em forma de spray ou mais conhecidos como bombinhas de asma. Esses, por sua vez, precisam ser agitados antes da inalação para que a medicação seja diluída nos gases do aerossol, garantindo sua homogeneidade e uniformidade na hora da aplicação.
Podemos considerar o gás que sai do aerossol como sendo um gás ideal, logo, sofre certa transformação em sua saída.
(UPE) Um gás ideal é submetido a um processo termodinâmico ABCD conforme ilustra a figura a seguir.

Sabendo que o trabalho total associado a esse processo é igual 1050J a qual o trabalho no subprocesso BCD?
(FUVEST) Certa quantidade de gás sofre três transformações sucessivas, A → B, B → C e C → A, conforme o diagrama p – V apresentado na figura abaixo.

A respeito dessas transformações, afirmou-se o seguinte:
I - O trabalho total realizado no ciclo ABCA é nulo.
II - A energia interna do gás no estado C é maior que no estado A.
III - Durante a transformação A → B o gás recebe calor e realiza trabalho.
Está correto o que se afirma em:
(UDESC) Um gás ideal é submetido a uma transformação isotérmica, conforme descrito no diagrama da figura.

Os valores da pressão \({P}_{x}\) e do volume \({V}_{y}\) indicados no diagrama são, respectivamente, iguais a:
TEXTO PARA A PRÓXIMA QUESTÃO:
Analise a figura a seguir e responda.

(UEL) Com referência à figura, assinale a alternativa que apresenta, correta e respectivamente, o valor da quantidade de calor Q para o caminho cda e o valor da energia interna U\(_a\) − U\(_c\).
(UFU) Em relação à Primeira e à Segunda Lei da Termodinâmica, é correto afirmar que:
(UDESC) O gráfico a seguir apresenta dois processos termodinâmicos distintos, utilizados para levar uma massa gasosa de gás ideal de uma temperatura inicial até uma temperatura T\(_x\). O primeiro (A) é um processo isobárico e o segundo (B) é um processo isocórico.
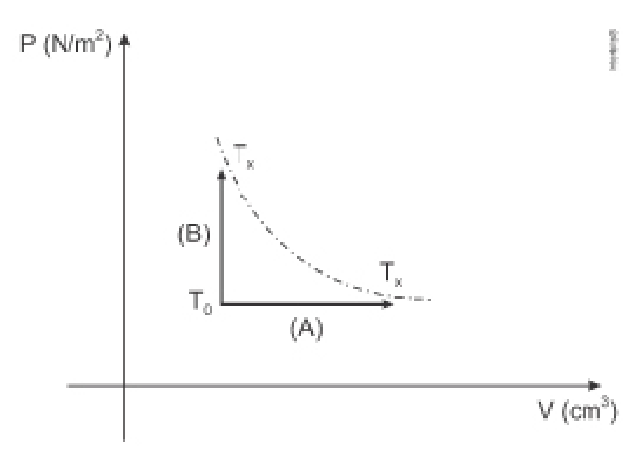
Analise as afirmativas a seguir, relacionadas aos processos termodinâmicos descritos no gráfico:
I - A variação de energia interna do gás foi a mesma nos dois processos.
II - A quantidade de calor fornecida ao gás foi a mesma nos dois processos.
III - A temperatura T\(_x\) é maior do que a temperatura T₀.
Assinale a alternativa CORRETA.
(UEPG-GO) A respeito do funcionamento da panela de pressão, assinale o que for correto.
(UFSC-SC) Assinale a(s) proposição(ões) CORRETA(S) a respeito do ciclo de Carnot:
(UFSC-SC) O uso de combustíveis não renováveis, como o petróleo, tem sérias implicações ambientais e econômicas. Uma alternativa energética em estudo para o litoral brasileiro é o uso da diferença de temperatura da água na superfície do mar (fonte quente) e de águas mais profundas (fonte fria) em uma máquina térmica para realizar trabalho. (Desconsidere a salinidade da água do mar para a análise das respostas).
Assinale a(s) proposição(ões) CORRETA(S).
(UFBA-BA) Com base nos conhecimentos sobre Termodinâmica, é correto afirmar:
(UEPG-GO) A termodinâmica pode ser definida como uma ciência experimental baseada em um pequeno número de princípios (leis da termodinâmica), que são generalizações feitas a partir da experiência. Sobre as leis da termodinâmica, assinale o que for correto.
Você chegou ao fim dessa aula com sucesso!
Selecione o botão avançar para seguir para a próxima aula.